Descrição
Clausius descreveu a primeira lei de outra forma, referindo-se a existência de uma função do estado do sistema chamada energia interna (U), expressa em termos de uma equação diferencial para os estados de um processo termodinâmico. Esta equação pode ser traduzido em palavras como se segue:
"Em um processo termodinâmico fechado, a alteração da energia interna do sistema é igual à diferença entre o alteração do calor acumulado pelo sistema e da alteração do trabalho realizado".
A energia interna é a soma das energias cinética e potencial de todas as partículas que constituem este sistema. Por esta razão, é considerada uma propriedade do sistema, depende somente do estado inicial e estado final do processo. Ainda, quanto maior a taxa de calor que está sendo transferida a determinado sistema, maior será sua energia interna. Assim, temos:
 , quando o sistema recebe calor
, quando o sistema recebe calor , quando o sistema perde calor
, quando o sistema perde calorDesta forma, quanto maior a energia interna de um sistema, maior será seu potencial para a realização de trabalho, sendo que convenciona-se que W>0, quando o sistema se expande e perde energia para o meio externo e W<0, quando o sistema se contrai e recebe energia do meio externo.
Termodinamicamente, se o estado de um sistema muda, então ele está passando por um processo. A sucessão de estados através da qual passa o sistema define o caminho do processo. Se, no final do processo, as propriedades tiverem regressado aos seus valores iniciais, o sistema foi submetido a um processo cíclico. A equação que descreve a relação entre a pressão, volume e temperatura é dada por

onde:
 é o número de mols e
é o número de mols e 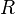 é a constante universal dos gases, R = 8,31 J/mol.K
é a constante universal dos gases, R = 8,31 J/mol.KMudanças no estado de um sistema são produzidas pela interação com o ambiente através de calor e trabalho. A Lei zero da termodinâmica define temperatura, enquanto a Primeira Lei define a função de estado Energia Interna. Podemos simplificar dizendo que existe uma função
 (energia interna) cuja variação durante uma transformação depende unicamente de dois estados, o inicial e o final. Num sistema fechado a indicação desta variação é dada como:
(energia interna) cuja variação durante uma transformação depende unicamente de dois estados, o inicial e o final. Num sistema fechado a indicação desta variação é dada como:
Na equação acima, convencionou-se Q positivo quando é acrescida energia ao sistema e negativo quando retirada; do mesmo modo, a energia interna diminui se for cedida energia para a vizinhança sob a forma de trabalho W, ou seja, se o sistema realizar trabalho.
- Para o cálculo de trabalho (W)

onde, F = pressão (p) . área (A)



onde p é a pressão e dV, volume na forma infinitesimal.
Pelo cálculo da integral,
 =
= 
Para o cálculo do calor (Q)

onde, c é o calor específico, m é a massa e T temperatura
Quando a mudança de estado físico, temos

onde, m é massa e L é calor de transformação (específico a cada substância)
Podemos transferir energia para dentro ou para fora do sistema, seja sob forma de calor ou pela forma de trabalho. Suponhamos que o sistema esteja em um estado inicial i e realiza trabalho, expandindo-se. Este trabalho mecânico diminui a energia interna do sistema, então:
 =
= 
Podemos também variar o estado do sistema colocando-o em contato térmico com outro sistema cuja temperatura esteja diferente. Assim, há certa quantidade de energia em trânsito, que se desloca do sistema de maior valor Q para o menor, fazendo com que haja um aumento da energia interna do sistema inicialmente com menor quantidade de energia. Assim,
 =
= 
Casos Especiais
 . A variação da energia interna se deve ao trabalho pelo sistema. Exemplo: desodorante aerossol e champagne.
. A variação da energia interna se deve ao trabalho pelo sistema. Exemplo: desodorante aerossol e champagne.- Processos a Volume Constante: Também chamado processo isocórico, o sistema não realiza trabalho, W = 0. A variação da energia interna depende da diferença de temperatura.
- Processos Cíclicos: A energia interna não varia porque obtém volume, pressão e temperatura iguais no estado inicial e final. O trabalho será negativo e corresponde à área dentro da figura. Por convenção: +W quando se desloca no sentido horário e -W quando desloca-se no sentido anti-horário.
- Expansões Livres: A temperatura não varia (transformação isotérmica). Ocorre uma ocupação de um espaço antes no vácuo, então trabalho e calor iguais à zero.
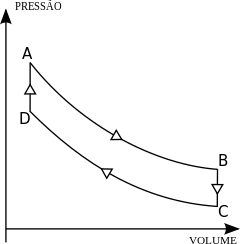
Representação do ciclo de Stirling
Diagrama de pressão do gás em função de Seu volume
 e
e  são processos isotérmicos (temperatura
são processos isotérmicos (temperatura  constante). Já os segmentos
constante). Já os segmentos 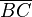 e
e  são processos isovolumétricos (volume
são processos isovolumétricos (volume 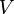 constante), sendo que a energia interna do sistema varia somente pela troca de calor com as vizinhanças do sistema
constante), sendo que a energia interna do sistema varia somente pela troca de calor com as vizinhanças do sistemaEm resumo
| Adiabático |  , ,  = - = -  |
| V constante |  , ,  = =  |
| Cíclicos |  , ,  |
| Expansões Livres |  , ,  |
Historia
Em meados do século XIX, um dos assuntos mais intrigantes aos cientistas da época era a transformação de calor em movimento através das máquinas térmicas. Neste período, ocorria a Revolução Industrial na Inglaterra e as máquinas térmicas a vapor foram as grandes responsáveis por parte do seu sucesso. O princípio dessas máquinas era bastante simples: aquecendo um gás ele se expandia. Em 1763, o escocês James Watt percebeu que havia um grande desperdício de vapor, que custava dinheiro e diminuía os lucros das indústrias. Entretanto, acredita-se que a primeira máquina térmica seja datada de 50 d.C e desenvolvida por Héron de Alexandria. Héron, descobriu que o ar se expandia quando aquecido, e assim, poderia utilizá-lo para produzir força mecânica. O grande Leonardo da Vinci também usou o vapor d'água para produzir movimentos.
Preocupado em aperfeiçoar as máquinas térmicas, o cientista francês Sadi Carnot (1796-1832), desenvolveu, em 1824, a teoria que explicava o rendimento de uma máquina, ou seja, quanto de calor a máquina transformava em trabalho. Ele então desenvolveu um modelo teórico para as máquinas térmicas e descobriu qual deveria ser a maneira mais eficiente de transformar calor em movimento. À esse modelo teórico, deu-se o nome de Máquina de Carnot.
O estabelecimento do princípio da conservação de energia também ocorreu no século XIX, em estudos da termodinâmica. Nessa época, já se sabia que o calor poderia ser gerado pelo atrito (energia mecânica), eletricidade e reações químicas. Por volta de 1840, o físico inglês Joule(1818-1889) em seus estudos, procurou quantificar a energia mecânica necessária que equivalesse à uma caloria. Em sua homenagem, atribuiu-se o seu nome à unidade de energia, Joule [J]. 1J = 4,186cal.
Em 1848,o engenheiro, físico e matemático William Thomson, também conhecido como Lorde Kelvin, publicou um artigo fundamentado na teoria de Carnot. Nele, buscou a equivalência entre a escala dos gases ideais e a escala termodinâmica, desenvolvendo uma escala cujas referências eram os pontos fixos: zero absoluto (0) e a temperatura do gelo fundente (273,16). Essa escala é utilizada até hoje e, em sua homenagem, sua unidade no SI é Kelvin [K].
Baseados nos trabalhos de Joule e um outro cientista, denominado Mayer, Rudolf Clausius e Lorde Kelvin, em 1850, desenvolveram a Primeira e a Segunda Lei da Termodinâmica. Isso, mudaria completamente a compreensão do calor como forma de energia e ampliou o campo de atuação da termodinâmica
Nenhum comentário:
Postar um comentário